创新药物从结构设计到发现、再到最终的获批上市,是一个充满挑战而又十分重要的过程。简要的说,首先是新化学实体NCE的发现,其主要包括先导化合物、候选药物的确定;之后进入到临床前研究阶段,这一过程主要包括药理、毒理、药代、处方前研究等内容;待完成初步临床前评价后,即将进入临床研究之时,开发公司申请人须向相应药审部门进行注册申报,这个节点就是IND申请;待药审部门通过IND申请或者没有反馈意见时,项目便进入到下一阶段,即I、II、III期临床研究;待临床前研究、临床研究全部或部分完成之后,如果达到了预期目的,即可提交新药上市申请NDA,以求获批上市销售;上市后,开发公司仍需对产品进行IV期临床研究和上市后监测,使之更加充分的理解药物的机理、范围、治疗作用、副作用,等等。
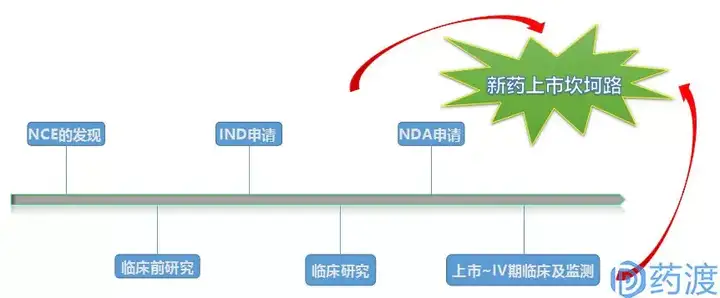
在阅读药品研发领域的相关文章时,我们经常会遇见IND、NDA、ANDA这三个缩写,今天我们就来一起认识一下。这三个缩写是指新药研发上市的不同阶段,是美国FDA新药申报程序的类型,在FDA官方网站上有详细的解释。
-
IND是Investigational New Drug 的缩写,是指新药临床研究审批,新药的产生需要进行两次行政审批,一是在临床研究阶段(IND申报),二是临床研究完成注册上市(NDA申报)。临床研究是指药物经过动物试验后,在人体上进行试验,分为Ⅰ期、Ⅱ期、Ⅲ期临床试验,每一期临床试验都有不同的试验目的,其中Ⅲ期临床试验人数最多,也是最关键的。
- NDA是New Drug Application 的缩写,是指新药经过临床试验后,申报注册上市的阶段。创新药物的产生需要经历五个阶段,分别是制备化合物阶段、临床前研究、临床研究、上市注册、新药监测。在临床研究后,药品上市前还有临门一脚,就是按照要求准备材料,进行注册上市申报(NDA申报)。经过NDA申报,药品获得批准后才能上市销售。
- ANDA是Abbreviated New Drug Application的缩写,即仿制药NDA申报。仿制药是对创新药的复制,仿制药也要进行NDA申报,但仿制药不需要进行临床试验,只需要证明其质量和疗效与原研药一致就行,所以他的NDA申报要简单地多,即ANDA中的Abbreviated就是简短的、简要的含义。