卵巢癌,早期缺少明显症状,多数患者在确诊时已是中晚期。卵巢癌诊断后5年生存率仅为47%,被称为“沉默的杀手”。
近几年来,随着PARP抑制剂的临床应用,卵巢癌的治疗,从以往的“手术+化疗+观察等待”模式进入到了“手术+化疗+维持治疗”的全程管理模式,使得卵巢癌治疗迈入了精准治疗时代。
业界研发PARP抑制剂最初是希望通过阻断高度突变的癌细胞中的DNA损伤修复,从而导致“毒性损伤”的积累来发挥抗癌作用。由于健康细胞内存在多条修复DNA的信号通路,因此仅抑制PARP对其毒性不会太大;但对于某些肿瘤细胞,由于BRCA等特定基因突变会破坏其它DNA修复通路,因此会对PARP抑制剂格外敏感,这也是携带BRCA突变的卵巢癌和乳腺癌患者更容易获益于PARP抑制剂的原因。
[TOC]
DNA损伤修复
DNA 作为细胞最重要的遗传物质,维持其稳定性和准确性至关重要。而人体内的细胞DNA在复制过程中,或者受到氧化或其他环境压力时会发生各种类型的损伤,因此这些损伤的修复对维持DNA稳定十分关键。
2015年,瑞典、美国、土耳其三位科学家Tomas Lindahl、Paul Modrich和Aziz Sancar因发现DNA损伤修复机制获得了诺贝尔化学奖。
DNA分子损伤通常有两种形式,一种为DNA单链断裂,一种为DNA双链断裂。

当DNA出现损伤时,细胞能启动六条修复通路来分别应对不同形式的损伤:
(1)直接修复(direct repair ,DR)通路,修复O6-烷基鸟嘌呤引起的损伤
(2)碱基切除修复(base excision repair,BER)通路,针对氧化还原或烷基化引起的碱基损伤
(3)核苷酸切除修复(nucleotide excision repair,NER)通路,修复辐射、化学药物或蛋白-DNA 交联引起的核苷酸水平的损伤
(4)碱基错配修复(mismatch repair,MMR)通路,纠正错配碱基
(5)同源重组修复(homologous recombination repair,HR)
(6)非同源的末端连接(non-homologous end joining,NHEJ)
PARP家族蛋白及其主要功能
Poly (ADP-ribose) polymerase (PARP) ,聚腺苷二磷酸核糖聚合酶,是参与聚腺苷二磷酸核糖(poly(ADP-ribose),PAR)合成的酶,即一种ADP-核糖通过核糖基化-核糖键相连的多聚体。
依据修饰基团是ADPR单体(MAR)还是其聚合物(PAR)),分为以下两类:
①单ADP-核糖化(mono ADP-ribosylation, MARylation):家族中的大多数其他酶只能构建单个ADP核糖(ADPribose)单元,因此被归类为mono(ADP-ribosyl)ases(MARs),即,单ADP核糖化酶;
②聚ADP-核糖化(poly ADP-ribosylation, PARylation):PARP家族中,PARP1、PARP2、PARP5A和PARP5B能够合成多个ADP核糖单元,即,聚ADP核糖化酶。
最典型的PARP家族成员PARP-1
PARP-1是最典型的PARP家族成员,在PARP家族中发挥90%以上的功能,由 1014个氨基酸残基组成,包括3个结构域,N端DNA结合域( DBD) 、中间自调节域( AD) 、C 端催化域( CAT) 。
其中N端DNA结合域包括3个锌指基序和DNA链断裂敏感元件( NLS) 。ZnⅠ,ZnⅡ识别损伤 DNA,ZnⅢ参与结构域之间的联系,活化蛋白。中间自调节域包括一个BRCA1的羧基端(DNA修复和细胞信号转导) 并有Capase-3酶切功能。C端催化域包括一个富含色氨酸-甘氨酸-精氨酸域(WGR)、α螺旋结构域(HD)ADP核糖转移酶结构域(ART)。
PARP-1蛋白结构示意图如下:

PARP的作用机制
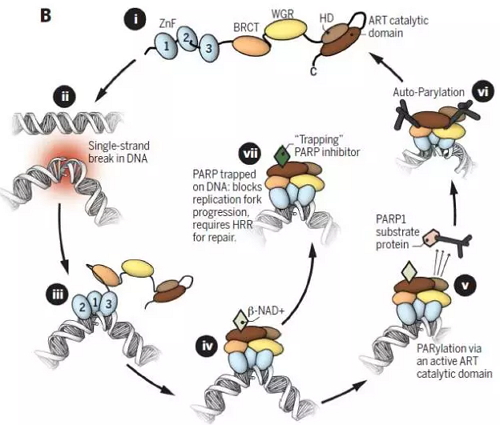
PARP-1 参与DNA修复的机制:

PARP抑制剂作用的分子机理
PARP1的作用是通过与DNA损伤位点相结合 (大多为单链DNA断裂) 并且催化多聚ADP核糖链在蛋白底物上的合成。通过这个催化作用,PARP1能够募集其它DNA修复蛋白到损伤位点共同修复DNA损伤。PARP抑制剂通过与PARP1或PARP2催化位点的结合,导致PARP蛋白无法从DNA损伤位点上脱落。被束缚在DNA上的PRAP在DNA复制时会导致DNA复制叉停滞和DNA复制无法顺利进行。这时候,细胞通常会激发称为同源重复修复(Homologous Recombination Repair, HRR)的修复方法来修复这个错误。BRCA1、BRCA2和其它称为“类BRCA” (BRCAness) 的蛋白在HRR中起到重要作用,当这些蛋白功能受损导致HRR功能失常时,细胞运用的其它DNA修复方法通常会引入大规模的基因组重组,从而导致细胞死亡。
最初开发PARP抑制剂的目的是将PARP与其它造成癌细胞DNA损伤的疗法 (如放疗和化疗) 一起使用,通过削弱癌细胞修复DNA损伤的能力来增强其它疗法的疗效。但是在2005年,研究人员发现携带BRCA突变的肿瘤细胞对PARP抑制剂的敏感度是携带野生型BRCA基因的肿瘤细胞的1000倍。这一重大发现大幅度推进了PARP抑制剂作为单一疗法在临床上的应用。
PARP抑制剂基本为烟酰胺腺嘌呤二核苷酸(NAD+)类似物,其分子作用机理是通过与NAD+竞争性结合PARP酶的催化域活性位点从而抑制PARP酶活性。
(1)PARP-1抑制剂通过与PARP-1的CAT(catalytic domain,C端催化域)竞争性结合,抑制其催化活性,使SSB(single strand break,单链断裂)得不到及时修复,产生DSB(double strand break,双链断裂);
(2)PARP-1抑制剂通过抑制PARP-1的自身PAR(poly ADP ribosylation,聚-ADP核糖基化)修饰、与CAT结合导致PARP-1变构,增强 PARP-1与损伤DNA的结合强度,将 PARP-1“捕获”于损伤DNA上,使细胞核中其他PARP-1 难以与损伤DNA结合,进一步阻断DSB的可能修复途径,促进细胞凋亡。
PARP-1抑制剂捕获PARP-1的能力与其抑制肿瘤细胞的活性正相关

PARP抑制剂,合成致死理念的首次成功实践
合成致死(synthetic lethality,SL)是指两个非致死性基因同时失活从而导致细胞死亡的现象。合成致死的概念是从模式生物的遗传研究中发现和提出的,例如果蝇和酵母。20世纪初期,美国遗传学家首次描述合成致死,他描述杂交黑腹果蝇中一些非等位基因中的基因组合同时突变是致命的。Synthetic在古希腊语中的意思是两个实体形式组合成一个新的东西,因此合成致死可以定义为当A基因和B基因当中任何一个基因发生突变还有生存能力,但是当两个基因同时发生突变就会引起死亡。合成致死也被定义为一类两个遗传事件共同发生,导致有机体或者细胞死亡的遗传作用。
人体内DNA损伤修复(DNA damage response,DDR)过程主要有两种机制:(1)聚腺苷二磷酸核糖聚合酶[poly(ADP-ribose) polymerase,PARP]参与的DNA单链断裂后的损伤修复。(2)BRCA1/2基因参与的同源重组修复(双链修复)。这两种DNA损伤修复机制保障了遗传物质复制、细胞分裂等过程的顺利进行。两种修复机制中的一种发生修复过程障碍时,另一种机制则可以代偿修复。如果细胞的这两种DNA损伤修复能力都受到抑制,则可能促进细胞的凋亡。随着对DDR的不断了解,PARP尽管主要作用于DNA的单链损伤修复,但也可协同BRCA修复DNA的双链损伤,当BRCA1/2突变失效时,PARP能接管BRCA在DNA修复过程中的作用。基于上述理论,在BRCA基因突变的肿瘤细胞中已经存在同源重组修复缺陷(Homologous Recombination Deficient,HRD),此时再应用PARP抑制剂,就能同时抑制单链断裂的损伤修复,使两种DNA损伤修复途径均出现障碍,进而促进肿瘤细胞的凋亡,发挥更强的抗肿瘤作用,即所谓的“合成致死”作用机制,也即PARP抑制剂杀灭癌细胞的主要机制。
需要指出的是,虽然PARP抑制剂通常与BRCA1或BRCA2种系基因突变联系在一起,但是它对其它肿瘤也可能产生疗效。许多肿瘤细胞虽然没有BRCA1/2种系基因突变,但是由于其它原因导致HRR缺陷,这些肿瘤细胞也可能对PARP抑制剂敏感。这将大大扩展PARP抑制剂的应用范围。已有研究表明一部分高度浆液性卵巢癌(High-grade Serous Ovarian Cancer), 晚期前列腺癌和胰腺癌患者可能会受益于PARP抑制剂疗法。为此,研究人员正在大力开发检测肿瘤细胞HRR功能的诊断方式和寻找与HRR缺陷相关的生物标记物。

已获批的PARP抑制剂
| 中文通用名 | 英文通用名 | 商品名 | 企业 | FDA批准 | FDA批准日期 | NMPA批准 | NMPA批准日期 |
|---|---|---|---|---|---|---|---|
| 奥拉帕利 | Olaparib | Lynparza | 阿斯利康 | 已批准 | 2014 | 已批准 | 2018 |
| 芦卡帕利 | Rucaparib | Rubraca | Clovis Oncology | 已批准 | 2016 | 未批准 | None |
| 尼拉帕利 | Niraparib | Zejula(则乐) | Tesaro/再鼎医药 | 已批准 | 2017 | 已批准 | 2020 |
| 他拉唑帕利 | Talazoparib | Talzenna | 辉瑞 | 已批准 | 2018 | 未批准 | None |
| 氟唑帕利 | Fluzoparib | 艾瑞颐 | 恒瑞 | 未批准 | None | 已批准 | 2020 |
| 帕米帕利 | Pamiparib | 百汇泽 | 百济神州 | 未批准 | None | 已批准 | 2021 |
已获批PARP抑制剂分子结构式
